摘要:抗生素clovibactin能夠有效地殺死耐藥的革蘭氏陽性細菌病原體,而不會產(chǎn)生可檢測到的耐藥性。
抗生素的引入徹底改變了醫(yī)學,為曾經(jīng)致命的傳染病提供了有效的治療方法,并使外科手術(shù)和器官移植等現(xiàn)代醫(yī)學成為可能。廣泛的耐藥性發(fā)展阻礙了抗生素的有效性和使用壽命,要求在與人類病原體的永久對峙中發(fā)現(xiàn)新的藥物。
2023年8月22日,荷蘭烏得勒支大學Markus Weingarth、德國波恩大學Tanja Schneider共同通訊在Cell 在線發(fā)表題為“An antibiotic from an uncultured bacterium binds to an immutable target”的研究論文,該研究發(fā)現(xiàn)了一種從未培養(yǎng)的土壤細菌中分離出來的抗生素clovibactin,它能夠有效地殺死耐藥的革蘭氏陽性細菌病原體,而不會產(chǎn)生可檢測到的耐藥性。

圖1 研究發(fā)現(xiàn)了一種從未培養(yǎng)的土壤細菌中分離出來的抗生素clovibactin
Clovibactin通過靶向多種必需肽聚糖前體(C55PP,脂質(zhì)II和脂質(zhì)IIIWTA)的焦磷酸鹽來阻斷細胞壁的合成。Clovibactin使用一種不尋常的疏水界面緊密包裹焦磷酸鹽,但繞過前體的可變結(jié)構(gòu)元素,導致缺乏抵抗力。選擇性和有效的靶標結(jié)合是通過將前體隔離到僅在含有脂錨定焦磷酸基團的細菌膜上形成的超分子原纖維中來實現(xiàn)的。這種有效的抗生素有希望設(shè)計出更好的治療方法,在不產(chǎn)生耐藥性的情況下殺死細菌病原體。
臨床上使用的大多數(shù)抗生素來源于天然產(chǎn)物骨架,這些骨架是通過篩選土壤棲息細菌而發(fā)現(xiàn)的。這種由“Waksman 平臺”引領(lǐng)的方法在20世紀40年代至60年代取得了巨大成功,被認為是抗生素發(fā)現(xiàn)的黃金時代,并最終導致了鏈霉素、萬古霉素或四環(huán)素等化合物的引入。然而,到目前為止,傳統(tǒng)的篩選來源似乎被破壞了,因為它們往往產(chǎn)生以前已知的化合物。由于藥物發(fā)現(xiàn)渠道已經(jīng)相當薄弱,因此在尚未開發(fā)的細菌生產(chǎn)者群體中尋找具有前所未有的作用機制的新抗生素是謹慎的。
在過去的幾十年里,傳統(tǒng)的篩選平臺未能引入新的抗生素,部分原因是放線菌的過度開采,放線菌是抗生素的傳統(tǒng)來源。通過獲取沉默的操縱子,發(fā)現(xiàn)被大量產(chǎn)生的抗菌素掩蓋的化合物,以及培養(yǎng)以前未培養(yǎng)的細菌,可能會發(fā)現(xiàn)新的抗生素。
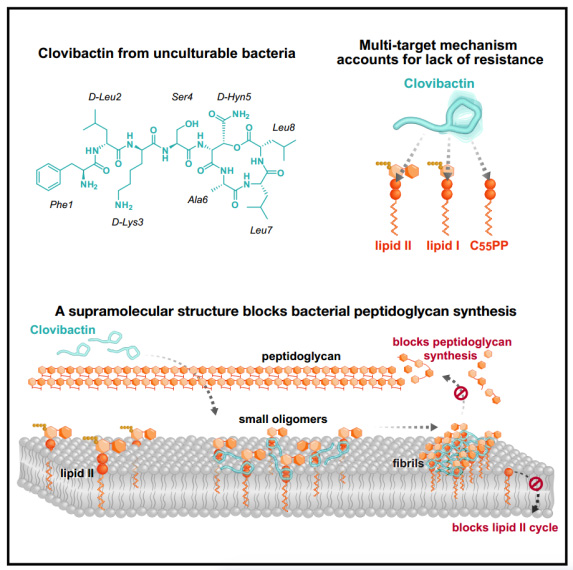
圖2 機理模式圖(圖源自Cell)
未培養(yǎng)的細菌代表了巨大的、未開發(fā)的新天然產(chǎn)物骨架來源。最近,iChip技術(shù)的發(fā)展提供了廣泛多樣性的未培養(yǎng)細菌物種,導致Teixobactin的發(fā)現(xiàn),其從土壤細菌Eleftheria terrae中分離出來。Teixobactin具有優(yōu)異的抗菌活性和獨特的化學結(jié)構(gòu)。Teixobactin通過特異性結(jié)合高度保守的脂質(zhì)前體來阻斷細胞壁的生物合成,導致超分子結(jié)構(gòu)的形成,從而擾亂膜的穩(wěn)定性。篩選未培養(yǎng)細菌后產(chǎn)生的其他具有新作用模式的抗生素是lassomycin (ClpP1P2C1蛋白酶抑制劑)和amycoactin (SecY蛋白輸出抑制劑),兩者都選擇性地作用于分枝桿菌。因此,未經(jīng)培養(yǎng)的細菌似乎提供了豐富的化合物來源,具有新的化學和機械特性,這預示著持續(xù)發(fā)現(xiàn)有效的線索來開發(fā)下一代抗生素。
該研究報告了clovibactin的發(fā)現(xiàn)和作用模式,是一種未檢測到耐藥性的抗生素,從未培養(yǎng)的細菌中鑒定出來。它是一種新的作用于細胞壁的抗生素, clovibactin對細胞壁前體PPi的作用是一個簡單的不可變靶點,它擴展了人們對為避免耐藥性而進化的抗生素的理解,并為合理設(shè)計具有長期臨床使用壽命的化合物指明了道路。。
參考資料
[1] An antibiotic from an uncultured bacterium binds to an immutable target
摘要:抗生素clovibactin能夠有效地殺死耐藥的革蘭氏陽性細菌病原體,而不會產(chǎn)生可檢測到的耐藥性。
抗生素的引入徹底改變了醫(yī)學,為曾經(jīng)致命的傳染病提供了有效的治療方法,并使外科手術(shù)和器官移植等現(xiàn)代醫(yī)學成為可能。廣泛的耐藥性發(fā)展阻礙了抗生素的有效性和使用壽命,要求在與人類病原體的永久對峙中發(fā)現(xiàn)新的藥物。
2023年8月22日,荷蘭烏得勒支大學Markus Weingarth、德國波恩大學Tanja Schneider共同通訊在Cell 在線發(fā)表題為“An antibiotic from an uncultured bacterium binds to an immutable target”的研究論文,該研究發(fā)現(xiàn)了一種從未培養(yǎng)的土壤細菌中分離出來的抗生素clovibactin,它能夠有效地殺死耐藥的革蘭氏陽性細菌病原體,而不會產(chǎn)生可檢測到的耐藥性。

圖1 研究發(fā)現(xiàn)了一種從未培養(yǎng)的土壤細菌中分離出來的抗生素clovibactin
Clovibactin通過靶向多種必需肽聚糖前體(C55PP,脂質(zhì)II和脂質(zhì)IIIWTA)的焦磷酸鹽來阻斷細胞壁的合成。Clovibactin使用一種不尋常的疏水界面緊密包裹焦磷酸鹽,但繞過前體的可變結(jié)構(gòu)元素,導致缺乏抵抗力。選擇性和有效的靶標結(jié)合是通過將前體隔離到僅在含有脂錨定焦磷酸基團的細菌膜上形成的超分子原纖維中來實現(xiàn)的。這種有效的抗生素有希望設(shè)計出更好的治療方法,在不產(chǎn)生耐藥性的情況下殺死細菌病原體。
臨床上使用的大多數(shù)抗生素來源于天然產(chǎn)物骨架,這些骨架是通過篩選土壤棲息細菌而發(fā)現(xiàn)的。這種由“Waksman 平臺”引領(lǐng)的方法在20世紀40年代至60年代取得了巨大成功,被認為是抗生素發(fā)現(xiàn)的黃金時代,并最終導致了鏈霉素、萬古霉素或四環(huán)素等化合物的引入。然而,到目前為止,傳統(tǒng)的篩選來源似乎被破壞了,因為它們往往產(chǎn)生以前已知的化合物。由于藥物發(fā)現(xiàn)渠道已經(jīng)相當薄弱,因此在尚未開發(fā)的細菌生產(chǎn)者群體中尋找具有前所未有的作用機制的新抗生素是謹慎的。
在過去的幾十年里,傳統(tǒng)的篩選平臺未能引入新的抗生素,部分原因是放線菌的過度開采,放線菌是抗生素的傳統(tǒng)來源。通過獲取沉默的操縱子,發(fā)現(xiàn)被大量產(chǎn)生的抗菌素掩蓋的化合物,以及培養(yǎng)以前未培養(yǎng)的細菌,可能會發(fā)現(xiàn)新的抗生素。

圖2 機理模式圖(圖源自Cell)
未培養(yǎng)的細菌代表了巨大的、未開發(fā)的新天然產(chǎn)物骨架來源。最近,iChip技術(shù)的發(fā)展提供了廣泛多樣性的未培養(yǎng)細菌物種,導致Teixobactin的發(fā)現(xiàn),其從土壤細菌Eleftheria terrae中分離出來。Teixobactin具有優(yōu)異的抗菌活性和獨特的化學結(jié)構(gòu)。Teixobactin通過特異性結(jié)合高度保守的脂質(zhì)前體來阻斷細胞壁的生物合成,導致超分子結(jié)構(gòu)的形成,從而擾亂膜的穩(wěn)定性。篩選未培養(yǎng)細菌后產(chǎn)生的其他具有新作用模式的抗生素是lassomycin (ClpP1P2C1蛋白酶抑制劑)和amycoactin (SecY蛋白輸出抑制劑),兩者都選擇性地作用于分枝桿菌。因此,未經(jīng)培養(yǎng)的細菌似乎提供了豐富的化合物來源,具有新的化學和機械特性,這預示著持續(xù)發(fā)現(xiàn)有效的線索來開發(fā)下一代抗生素。
該研究報告了clovibactin的發(fā)現(xiàn)和作用模式,是一種未檢測到耐藥性的抗生素,從未培養(yǎng)的細菌中鑒定出來。它是一種新的作用于細胞壁的抗生素, clovibactin對細胞壁前體PPi的作用是一個簡單的不可變靶點,它擴展了人們對為避免耐藥性而進化的抗生素的理解,并為合理設(shè)計具有長期臨床使用壽命的化合物指明了道路。。
參考資料
[1] An antibiotic from an uncultured bacterium binds to an immutable target



